近日,bet体育365官网网站、江苏省富碳材料器件工程研究中心张袁健教授团队(https://carbosensing.group)报道了Fe-N-C纳米酶在催化抗坏血酸氧化反应中的机制研究,相关成果以“Insights into Iron Leaching from an Ascorbate-Oxidase-like Fe-N-C Nanozyme and Oxygen Reduction Selectivity”为题在化学领域国际权威学术期刊Angew. Chem. Int. Ed.以VIP Paper形式在线发表。
抗坏血酸(H2A,又称维生素C)是一种广泛存在于各种食物中的维生素,它是一种抗氧化剂,可帮助保护细胞免受自由基的影响。近年来,抗坏血酸也被作为一种高效的促氧化剂,用于癌症治疗。然而,抗坏血酸“抗氧化”和“促氧化”作用相互“矛盾”,人们尚不清楚该生物医学功能双面性背后的分子机制,阻碍了抗坏血酸在生物医学中的应用。
由于在原子水平上具有与天然酶相似的催化中心,单原子纳米酶被视为天然酶的模拟物,被广泛应用于生物传感、药物相互作用和疾病治疗等领域。鉴于此,近日,bet体育365官网网站张袁健教授课题组提出使用Fe-N-C纳米酶作为铁蛋白模拟物探索抗坏血酸催化氧化反应的机制。
该团队发现Fe-N-C纳米酶是一种多相催化剂,具有N-C和Fe-Nx两种活性位点,Fe-N-C中的Fe-Nx位点主要通过结合态中间体催化抗坏血酸氧化和四电子氧还原,同时,少量N-C位点催化二电子氧还原,催化过程中产生痕量超氧阴离子并诱导Fe-N-C中不稳定的Fe-Nx游离为Fe离子。进而,经N-C位点催化产生的过氧化氢与游离的Fe离子形成芬顿体系,衍生出一个新的四电子氧还原过程。更为重要的是,当游离的Fe离子远离催化剂时,由于抗坏血酸催化氧化过程中Fe-Nx活性位点含量的下降,更多的N-C活性位点被激活,从而直接导致过氧化氢产率上升。该研究率先发现Fe-N-C纳米酶催化抗坏血酸氧化过程中的Fe离子的析出现象,并揭示了一个新的氧气还原途径,对理解抗坏血酸促氧化效应用于清除癌细胞提供了一个新思路。
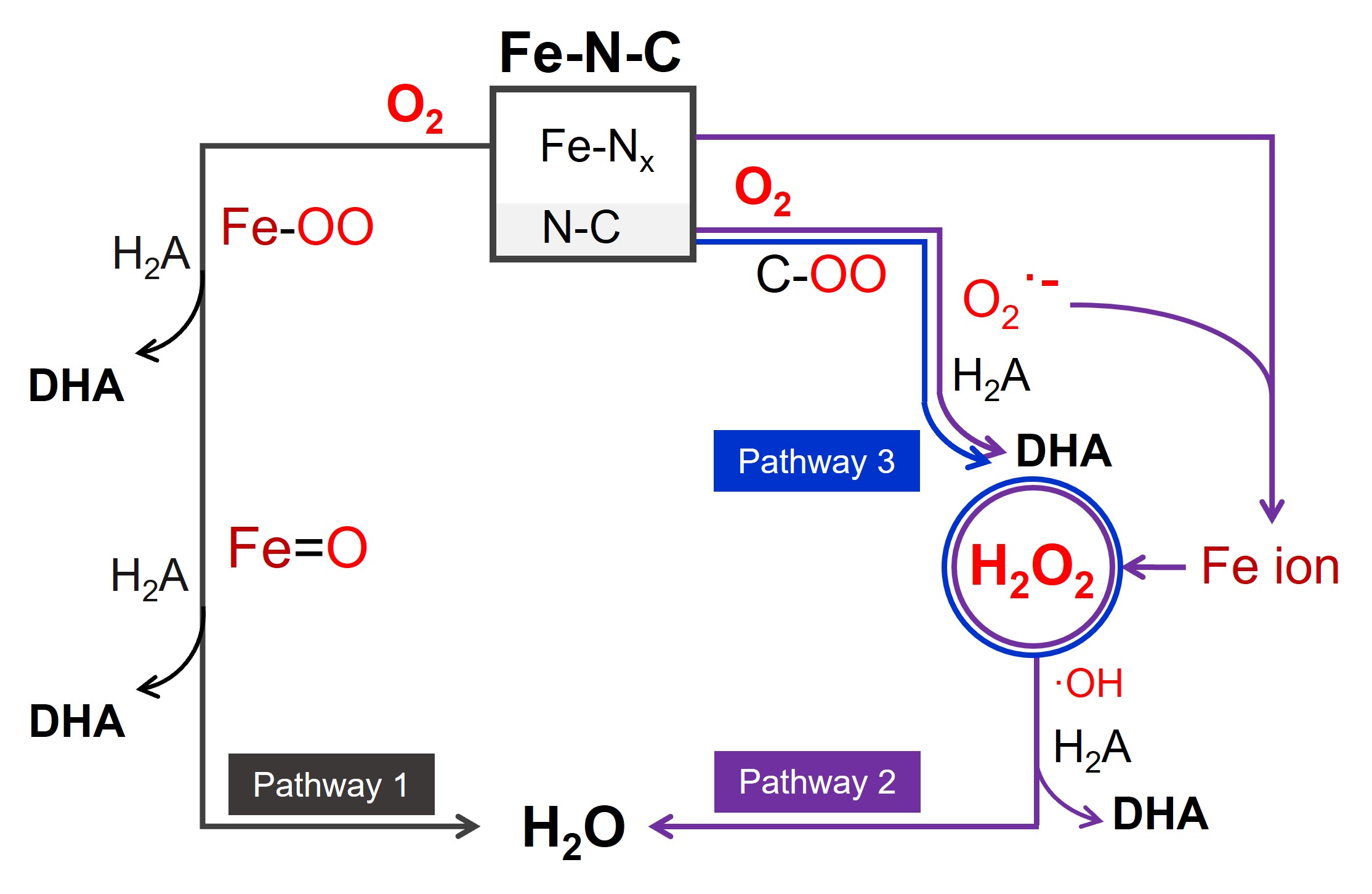
Fe-N-C纳米酶催化抗坏血酸氧化的三种路径(图片来自Angew. Chem. Int. Ed.)
bet体育365官网网站的硕士生曹栩雯和博士生朱彩霞为本工作共同第一作者,通讯作者为bet体育365官网网站张袁健教授和医学院沈艳飞教授,bet体育365官网网站为该工作的唯一完成单位,该工作得到了国家自然科学基金的资助。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202302463

